Submucosale tumoren (SMT) van het maag-darmkanaal zijn verheven laesies die ontstaan uit de muscularis mucosa, submucosa of muscularis propria, en kunnen ook extraluminale laesies zijn. Met de ontwikkeling van medische technologie zijn traditionele chirurgische behandelingsopties geleidelijk aan overgegaan naar het tijdperk van minimaal invasieve behandelingen, zoals lParascopische chirurgie en robotchirurgie. In de klinische praktijk blijkt echter dat "chirurgie" niet voor alle patiënten geschikt is. De laatste jaren heeft de waarde van endoscopische behandeling steeds meer aandacht gekregen. De meest recente versie van de Chinese expertconsensus over endoscopische diagnose en behandeling van submucosale tumoren (SMT) is gepubliceerd. Dit artikel zal de relevante kennis kort bespreken.
1. Kenmerken van de SMT-epidemieristiek
(1) De incidentie van SMDe T-celverdeling is ongelijkmatig in verschillende delen van het spijsverteringskanaal, en de maag is de meest voorkomende locatie voor SMT.
De incidentie van diverseDe verdeling van de tumoren over de verschillende delen van het spijsverteringskanaal is ongelijk, waarbij de tumoren in het bovenste deel van het spijsverteringskanaal het meest voorkomen. Van deze tumoren bevinden 2/3 zich in de maag, gevolgd door de slokdarm, de twaalfvingerige darm en de dikke darm.
(2)De histopathologischeDe verschillende typen SMT zijn complex, maar de meeste SMT zijn goedaardige laesies en slechts enkele zijn kwaadaardig.
A.SMT bevat geenn-neoplastische afwijkingen zoals ectopisch pancreasweefsel en neoplastische laesies.
B. Onder de neoplastische laesiesGastro-intestinale leiomyomen, lipomen, Brucella-adenomen, granulosaceltumoren, schwannomen en glomustumoren zijn meestal goedaardig, en minder dan 15% kan zich voordoen als kwaadaardig weefsel.
C. Gastro-intestinale stromaGist- en stromale tumoren (GIST) en neuro-endocriene tumoren (NET) in SMT zijn tumoren met een zeker kwaadaardig potentieel, maar dit hangt af van hun grootte, locatie en type.
D. De locatie van SMT is gerelateerdVolgens de pathologische classificatie: a. Leiomyomen zijn een veelvoorkomend pathologisch type submucosaal tumorweefsel (SMT) in de slokdarm, goed voor 60% tot 80% van de SMT's in de slokdarm, en komen vaker voor in de middelste en onderste delen van de slokdarm; b. De pathologische typen submucosaal tumorweefsel in de maag zijn relatief complex, met onder andere GIST en leiomyomen.leiomyoom en ectopische alvleesklier zijn het meest voorkomend. Bij submucosale tumoren van de maag wordt GIST het meest gevonden in de fundus en het corpus van de maag, leiomyoom bevindt zich meestal in de cardia en het bovenste deel van het corpus, en ectopische alvleesklier en ectopische alvleesklier komen het meest voor. Lipomen komen vaker voor in het antrum van de maag; c. Lipomen en cysten komen vaker voor in het dalende en bulbaire deel van de twaalfvingerdarm; d. Bij submucosale tumoren van het onderste deel van het maag-darmkanaal komen lipomen vooral voor in de dikke darm, terwijl neuro-endocriene tumoren (NET's) vooral in het rectum voorkomen.
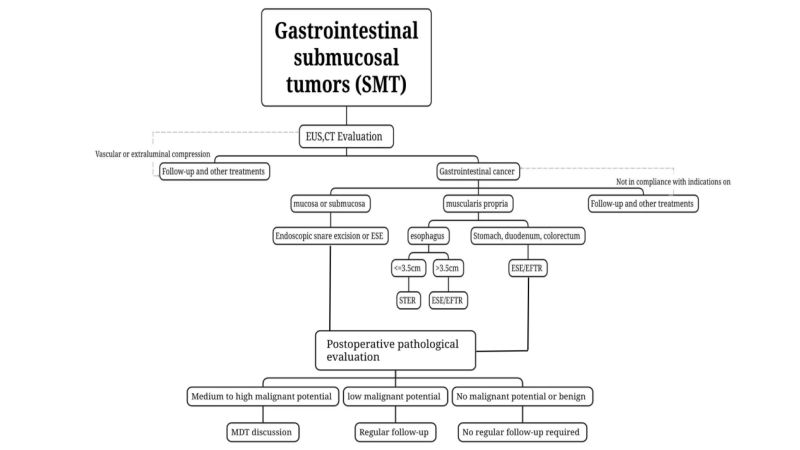
(3) Gebruik CT en MRI om tumoren te classificeren, te behandelen en te evalueren. Voor SMT's waarvan wordt vermoed dat ze mogelijk kwaadaardig zijn of die grote tumoren hebben (langdurig).Bij een diameter groter dan 2 cm worden CT- en MRI-scans aanbevolen.
Andere beeldvormingsmethoden, waaronder CT en MRI, zijn ook van groot belang voor de diagnose van SMT. Ze kunnen direct de locatie van de tumor, het groeipatroon, de grootte en vorm van de laesie, de aanwezigheid of afwezigheid van lobulatie, de dichtheid, de homogeniteit, de mate van contrastversterking en de begrenzing ervan weergeven. Ook kunnen ze de aanwezigheid en de mate van verdikking van de tumor aantonen.Vernauwing van de gastro-intestinale wand. Belangrijker nog, deze beeldvormende onderzoeken kunnen detecteren of er sprake is van invasie van aangrenzende structuren van de laesie en of er metastasen zijn in het omliggende peritoneum, lymfeklieren en andere organen. Ze vormen de belangrijkste methode voor klinische gradering, behandeling en prognosebepaling van tumoren.
(4)Weefselafname wordt niet aanbevolenAanbevolen voor goedaardige submucosale tumoren (SMT's) die kunnen worden gediagnosticeerd met conventionele endoscopie in combinatie met EUS, zoals lipomen, cysten en ectopische alvleesklier.
Bij laesies die verdacht worden van maligniteit, of wanneer conventionele endoscopie in combinatie met EUS geen onderscheid kan maken tussen goedaardige en kwaadaardige laesies, kan EUS-geleide fijne-naaldaspiratie/biopsie worden gebruikt (endoscopische echografie-geleide fijne-naaldaspiratie).Naaldaspiratie/biopsie, EUS-FNA/FNB), mucosale incisiebiopsie (mucosale incisie-ondersteunde biopsie, MIAB), enz. worden gebruikt om biopten te nemen voor preoperatieve pathologische evaluatie. Gezien de beperkingen van EUS-FNA en de daaruit voortvloeiende impact op endoscopische resectie, kunnen patiënten die in aanmerking komen voor endoscopische chirurgie, mits de tumor volledig kan worden verwijderd, in centra met geavanceerde endoscopische behandeltechnologie direct endoscopisch worden behandeld door een ervaren endoscopist, zonder voorafgaande pathologische diagnose.
Elke methode om pathologische monsters te verkrijgen vóór een operatie is invasief en zal het slijmvlies beschadigen of verklevingen aan het submucosale weefsel veroorzaken, waardoor de operatie moeilijker wordt en mogelijk het risico op bloedingen en perforaties toeneemt.verhouding en tumorverspreiding. Daarom is een preoperatieve biopsie niet per se nodig. Vooral bij submucosale tumoren (SMT's) die gediagnosticeerd kunnen worden met conventionele endoscopie in combinatie met EUS, zoals lipomen, cysten en ectopische alvleesklier, is geen weefselafname nodig.
2. SMT endoscopische behandelingnt
(1) Behandelingsprincipes
Tumoren zonder lymfekliermetastasen of met een zeer laag risico op lymfekliermetastasen, die volledig endoscopisch verwijderd kunnen worden en een laag risico op achtergebleven tumorweefsel en recidief hebben, komen in aanmerking voor endoscopische resectie indien behandeling noodzakelijk is. Volledige verwijdering van de tumor minimaliseert achtergebleven tumorweefsel en het risico op recidief.Het principe van tumorvrije behandeling moet worden gevolgd tijdens endoscopische resectie, en de integriteit van het tumorkapsel moet tijdens de resectie worden gewaarborgd.
(2) Indicaties
i. Tumoren met een kwaadaardig potentieel die worden vermoed op basis van preoperatief onderzoek of bevestigd door pathologisch onderzoek van een biopsie, met name die welke worden vermoed van gastro-intestinale aard.ST-tumoren met een preoperatieve beoordeling van een tumorlengte van ≤2 cm en een laag risico op recidief en metastase, en met de mogelijkheid tot volledige resectie, kunnen endoscopisch worden verwijderd; voor tumoren met een lange diameter >2 cm geldt dat, indien lymfeklier- of metastasen op afstand zijn uitgesloten tijdens de preoperatieve evaluatie, en onder de voorwaarde dat de tumor volledig kan worden verwijderd, endoscopische chirurgie kan worden uitgevoerd door ervaren endoscopisten in een centrum met geavanceerde endoscopische behandeltechnologie.
ii. Symptomatische (bijv. bloeding, obstructie) SMT.
iii. Patiënten bij wie de tumoren op basis van preoperatief onderzoek als goedaardig worden beschouwd of door pathologisch onderzoek zijn bevestigd, maar die niet regelmatig kunnen worden gecontroleerd of bij wie de tumoren binnen korte tijd tijdens de follow-upperiode in omvang toenemen en die een sterke wens hebben ome voor endoscopische behandeling.
(3) Contra-indicaties
i. Identificeer de laesies die mijgetransporteerd naar lymfeklieren of andere plaatsen elders in het lichaam.
ii. Voor sommige SMT met heldere lymfenodeBij uitzaaiingen op afstand is een bulkbiopsie nodig voor pathologisch onderzoek, wat als een relatieve contra-indicatie kan worden beschouwd.
iii. Na een gedetailleerde preoperatieve controleNa evaluatie is vastgesteld dat de algemene toestand slecht is en dat endoscopische chirurgie niet mogelijk is.
Goedaardige afwijkingen zoals lipomen en ectopische alvleesklier veroorzaken over het algemeen geen symptomen zoals pijn, bloedingen en obstructie. Wanneer SWanneer MT zich manifesteert als erosie, zweer of snelle groei in korte tijd, neemt de kans op een kwaadaardige laesie toe.
(4) Keuze van de resectiemethoded
Endoscopische snare-resectie: VoorAls een submucosaal tumorweefsel (SMT) relatief oppervlakkig is, in de lichaamsholte uitsteekt zoals vastgesteld door middel van preoperatieve EUS- en CT-onderzoeken, en in één keer volledig kan worden verwijderd met een lus, kan endoscopische lusresectie worden toegepast.
Uit binnenlandse en buitenlandse studies is gebleken dat het veilig en effectief is bij oppervlakkige submucosale tumoren (<2 cm), met een bloedingsrisico van 4% tot 13% en een risico op perforatie.risico van 2% tot 70%.
Endoscopische submucosale excavatie (ESE): Voor submucosale tumoren met een lange diameter van ≥2 cm of als preoperatieve beeldvormende onderzoeken zoals EUS en CT-scans de aanwezigheid van een submucosaal tumor bevestigen.Als de tumor in de holte uitsteekt, is ESE een haalbare optie voor endoscopische sleeve-resectie van kritische SMT's.
ESE volgt de technische werkwijzen vanEndoscopische submucosale dissectie (ESD) en endoscopische mucosale resectie maken routinematig gebruik van een cirkelvormige "flip-top"-incisie rond de tumor om het slijmvlies dat de submucosale tumor bedekt te verwijderen en de tumor volledig bloot te leggen. Dit heeft als doel de integriteit van de tumor te behouden, de radicaliteit van de operatie te verbeteren en intraoperatieve complicaties te verminderen. Bij tumoren ≤1,5 cm kan een complete resectie van 100% worden bereikt.
Submucosale tunnel endoscopische resectieSTER: Voor submucosale tumoren (SMT) die ontstaan in de muscularis propria van de slokdarm, het hilum, de kleine kromming van de maag, het maagantrum en het rectum, waar het gemakkelijk is om tunnels te vormen en de transversale diameter ≤ 3,5 cm is, kan STER de voorkeursbehandeling zijn.
STER is een nieuwe technologie die is ontwikkeld op basis van perorale endoscopische oesofageale sfincterotomie (POEM) en is een uitbreiding van de ESD-techniek.technologie. Het percentage en-bloc-resecties van STER voor SMT-behandeling bedraagt 84,9% tot 97,59%.
Endoscopische volledige resectieEFTR kan worden gebruikt voor SMT wanneer het moeilijk is een tunnel te graven of wanneer de maximale transversale diameter van de tumor ≥ 3,5 cm is en STER niet geschikt is. EFTR kan worden toegepast als de tumor onder het paarse membraan uitsteekt of buiten een deel van de holte groeit, en tijdens de operatie blijkt dat de tumor stevig aan de serosa vastzit en niet kan worden losgemaakt. EFTR is een endoscopische behandeling.
Correcte hechting van de perforatieDe locatie na EFTR is cruciaal voor het succes van de ingreep. Om het risico op tumorrecidief nauwkeurig te kunnen inschatten en de kans op tumorverspreiding te verkleinen, wordt afgeraden om het verwijderde tumorweefsel tijdens de EFTR te verwijderen. Indien het noodzakelijk is om de tumor in stukken te verwijderen, dient de perforatie eerst te worden gehecht om het risico op tumoruitzaaiing te verminderen. Enkele hechtmethoden zijn: hechting met metalen clips, hechting met zuigclips, hechting met omentumlapjes, de "tasjeshechting"-methode met nylon touw in combinatie met metalen clips, het over-the-scope clip (OTSC) sluitingssysteem met metalen clips, OverStitch-hechting en andere nieuwe technologieën voor het herstellen van gastro-intestinale verwondingen en het stoppen van bloedingen, enzovoort.
(5)Postoperatieve complicaties
Intraoperatieve bloeding: Bloeding die ervoor zorgt dat het hemoglobinegehalte van de patiënt met meer dan 20 g/L daalt.
Om massale bloedingen tijdens de operatie te voorkomen,Tijdens de operatie moet voldoende submucosale injectie worden toegediend om grotere bloedvaten bloot te leggen en elektrocoagulatie te vergemakkelijken om bloedingen te stoppen. Intraoperatieve bloedingen kunnen worden behandeld met verschillende incisiemessen, hemostatische tangen of metalen clips, en door preventieve hemostase van blootgelegde bloedvaten die tijdens de dissectie worden aangetroffen.
Postoperatieve bloeding: Postoperatieve bloeding uit zich in bloedbraken, melena (bloed in de ontlasting) of bloed in de ontlasting. In ernstige gevallen kan hemorragische shock optreden. Dit treedt meestal binnen een week na de operatie op, maar kan ook twee tot vier weken later voorkomen.
Postoperatieve bloedingen houden vaak verband metFactoren zoals een slechte bloeddrukregulatie na de operatie en corrosie van resterende bloedvaten door maagzuur kunnen bijdragen aan postoperatief bloedverlies. Daarnaast is postoperatief bloedverlies ook gerelateerd aan de locatie van de aandoening en komt het vaker voor in het maagantrum en het onderste deel van het rectum.
Vertraagde perforatie: Manifesteert zich meestal als een opgezette buik, verergerende buikpijn, tekenen van peritonitis, koorts en beeldvormend onderzoek dat gasophoping of een toename van de gasophoping ten opzichte van voorheen aantoont.
Het houdt vooral verband met factoren zoals slecht hechten van wonden, overmatige elektrocoagulatie, te vroeg opstaan om te bewegen, te vroeg eten, slechte bloedsuikerregulatie en erosie van wonden door maagzuur. a. Als de wond groot of diep is of als de wond open isa. Bij duidelijke veranderingen moeten de bedrust en vastenperiode naar behoren worden verlengd en moet na de operatie gastro-intestinale decompressie worden uitgevoerd (patiënten na een operatie aan het onderste deel van het maag-darmkanaal moeten een drainage van de anus ondergaan); b. Diabetici moeten hun bloedsuiker strikt controleren; patiënten met kleine perforaties en milde thoracale en abdominale infecties moeten worden behandeld met vasten, anti-infectiemiddelen en zuurremmers; c. Bij patiënten met vochtophoping kunnen gesloten thoraxdrainage en abdominale punctie worden uitgevoerd. Er moeten drains worden geplaatst om een vlotte drainage te garanderen; d. Als de infectie na conservatieve behandeling niet kan worden gelokaliseerd of als er sprake is van een ernstige thoracoabdominale infectie, moet zo snel mogelijk een laparoscopische chirurgische ingreep worden uitgevoerd, waarbij de perforatie wordt hersteld en abdominale drainage wordt toegepast.
Complicaties gerelateerd aan gasvorming: inclusief subcutanenieuw emfyseem, pneumomediastinum, pneumothorax en pneumoperitoneum.
Intraoperatief subcutaan emfyseem (weergegeven als emfyseem op het gezicht, de nek, de borstwand en het scrotum) en mediastinaal pneumofyseem (sEen zwelling van de epiglottis (die tijdens een gastroscopie kan worden vastgesteld) vereist meestal geen speciale behandeling en het emfyseem verdwijnt over het algemeen vanzelf.
Er treedt een ernstige pneumothorax op.tijdens een operatie [de luchtwegdruk overschrijdt 20 mmHg tijdens de operatie]
(1 mmHg = 0,133 kPa), SpO2 < 90%, bevestigd door spoed-röntgenfoto van de borstkas aan het bed], kan de operatie vaak worden voortgezet na gesloten thoraxdrainage.leeftijd.
Bij patiënten met een duidelijk pneumoperitoneum tijdens de operatie, dient een pneumoperitoneumnaald te worden gebruikt om het McFarland-punt aan te prikken.In de rechteronderbuik wordt de lucht verwijderd. De punctienaald blijft zitten tot het einde van de ingreep en wordt pas verwijderd nadat is gecontroleerd of er geen gas meer ontsnapt.
Gastro-intestinale fistel: Spijsverteringsvocht, afkomstig van een endoscopische ingreep, stroomt via een lekkage in de borst- of buikholte.
Oesofageale mediastinale fistels en oesofagothoracale fistels komen vaak voor. Zodra een fistel ontstaat, moet gesloten thoraxdrainage worden uitgevoerd om de fistel te behouden.voor een vlotte drainage en adequate voedingsondersteuning. Indien nodig kunnen metalen clips en diverse afsluitmechanismen worden gebruikt, of de volledige bedekking kan worden hergebruikt. Stents en andere methoden worden gebruikt om de drainage te blokkeren.fistel. Ernstige gevallen vereisen een snelle chirurgische ingreep.
3. Postoperatief management (f(vervolg)
(1) Goedaardige afwijkingen:PathologieDit suggereert dat goedaardige afwijkingen zoals lipomen en leiomyomen geen verplichte regelmatige controle vereisen.
(2) SMT zonder kwaadaardigmierenpotentieel:Bijvoorbeeld bij rectale NET's van 2 cm en GIST's met een gemiddeld tot hoog risico, dient een volledige stadiëring te worden uitgevoerd en moeten aanvullende behandelingen (chirurgie, chemoradiotherapie, doelgerichte therapie) sterk worden overwogen. Het behandelplan moet worden opgesteld in overleg tussen verschillende disciplines en op individuele basis.
(3) Laag maligne potentieel SMT:Een GIST met een laag risico moet bijvoorbeeld elke 6 tot 12 maanden na de behandeling worden geëvalueerd met behulp van endoscopische echografie (EUS) of beeldvorming, en vervolgens worden behandeld volgens de klinische instructies.
(4) SMT met een gemiddeld en hoog maligne potentieel:Indien postoperatief pathologisch onderzoek een type 3 maag-NET, een colorectale NET met een lengte van >2 cm en een GIST met een gemiddeld of hoog risico bevestigt, dient een volledige stadiëring te worden uitgevoerd en dienen aanvullende behandelingen (chirurgie, chemoradiotherapie, doelgerichte therapie) sterk te worden overwogen. Het behandelplan dient gebaseerd te zijn op[over ons 0118.docx] Multidisciplinair overleg en op individuele basis.
Wij, Jiangxi Zhuoruihua Medical Instrument Co., Ltd., zijn een fabrikant in China die gespecialiseerd is in endoscopische verbruiksartikelen, zoals...biopsietang, hemoclip, poliepenlus, sclerotherapienaald, spuitkatheter, cytologieborstels, geleidedraad, steenbergmand, neusgalafvoerkatheterenz. die veelvuldig worden gebruikt inEMR, ESD,ERCPOnze producten zijn CE-gecertificeerd en onze fabrieken zijn ISO-gecertificeerd. Onze goederen worden geëxporteerd naar Europa, Noord-Amerika, het Midden-Oosten en delen van Azië, en worden alom gewaardeerd door onze klanten.
Geplaatst op: 18 januari 2024


